Fra de danske børnekræftafdelinger i Aalborg, Aarhus, Odense og Rigshospitalet, februar 2024
Forekomst af ALL
Akut leukæmi (blodkræft) er den almindeligste kræftform hos børn. Sygdommen, der hvert år rammer 40-50 børn i Danmark, er dermed ansvarlig for næsten en tredjedel af alle kræfttilfælde hos børn.
Der er to hovedtyper af akut leukæmi:
-
Akut lymfoblastær leukæmi (ALL), hvor leukæmicellen er en umoden lymfecelle (lymfoblast).
-
Akut myeloblastær leukæmi (AML), hvor leukæmicellen er en umoden myeloidcelle (myeloblast).
ALL udgør ca. 85% af leukæmitilfældene hos børn. Sygdommen kan ramme børn i alle aldersklasser, men forekommer oftest i alderen 2-6 år. Den er lidt hyppigere hos drenge end hos piger.
Årsagen til sygdommen er ikke kendt. Kraftig radioaktiv bestråling (Hiroshima, Tjernobyl) kan fremkalde leukæmi, men ellers er ydre påvirkninger uden betydning. Langt de fleste tilfælde af leukæmi er ikke nedarvede, og det er meget sjældent, at der forekommer flere end et leukæmitilfælde i en familie. Man kender dog til enkelte sjældne såkaldte syndromer, der medfører øget risiko for leukæmi (f.eks. børn med Down syndrom, "mongolbørn").
Nyere forskning har vist, at nogle børn og unge udvikler kræft på baggrund af forandringer i deres arvemateriale. Derfor anbefales det nu, at alle børn med nydiagnosticeret kræft tilbydes omfattende genetisk undersøgelse af det medfødte arvemateriale og der kan foregå projekter på afdelingerne, hvor man undersøger dette mere detaljeret. Generelt er leukæmi ikke arveligt. Leukæmi er heller ikke smitsom. Søskende til børn med leukæmi har således ikke højere risiko for at få leukæmi end andre børn.
Biologi ved ALL
Ved leukæmi vokser de ondartede celler “uhæmmet” i knoglemarven, fortrænger den normale knoglemarv og fremkalder dermed symptomer på knoglemarvssvigt.
Den normale knoglemarv producerer tre typer blodceller:
- røde blodlegemer (erytrocytter), som har til opgave at transportere ilt rundt i kroppen,
- hvide blodlegemer (leukocytter, blandt andre neutrofile), som bekæmper bakterier og
- blodplader (trombocytter), som stopper blødning.
Herudover findes der i knoglemarv og i lymfevæv en anden slags hvide blodlegemer:
- lymfeceller (lymfocytter), som kan bekæmpe bakterier og virus bl.a. ved at producere antistoffer.
Hvis knoglemarven fortrænges, bliver de typiske symptomer:
- blodmangel (lav hæmoglobin, anæmi) med bleghed og træthed,
- tendens til bakterielle infektioner med feber,
- blødningstendens, især i form af blå mærker og røde punktformede blødninger (petekkier) i huden. Undertiden også slimhindeblødning fra næse, mund eller tarm.
Det er sjældent, at leukæmien fortrænger lymfecellerne (lymfocytterne), men de kan blive påvirkede under den langvarige kemoterapi.
Væksten af leukæmi i knoglerne kan bevirke smerter og knogleforandringer. Fra knoglemarven vil leukæmicellerne spredes til blodet og derfra slå sig ned i lymfeknuder og andre organer (milt, lever) og i nogle tilfælde kan sygdommen også vise sig i testikler eller centralnervesystemet. Uanset om der er tydelige tegn til udbredning, må det altid antages, at leukæmi har bredt sig til hele kroppen og ikke kun findes i knoglemarven.
Sygdomstegn ved ALL
Symptomerne på ALL kan udvikle sig gradvist over flere måneder, men ofte i løbet af blot nogle få uger. Typisk bliver barnet blegt og træt, pirreligt, får dårlig appetit med vægttab, der kommer feberepisoder, og der indtræder hudblødninger. Knoglesmerter eller gigtlignende smerter i et eller flere led kan forekomme, især i benene, undertiden som det første symptom på sygdommen. I sjældne tilfælde opstår der meningitislignende symptomer pga. leukæmi i hjernehinderne.
På diagnosetidspunktet er de fleste børn alment påvirkede med symptomer på knoglemarvssvigt, og der er ofte forstørrelse af lymfeknuder, lever eller milt. I en blodprøve vil der være påvirkning af hæmoglobin og af antallet af hvide blodlegemer og blodplader.
Undersøgelser
Ofte kan man få en næsten sikker diagnose ved påvisning af leukæmiceller i blodet, men diagnosen skal altid bekræftes ved en knoglemarvsundersøgelse. Marvprøven suges ud fra hoftebenskammen og samtidig tages prøve af rygmarvsvæsken (spinalvæsken) ved punktur i lænderyggen (lumbalpunktur). Disse undersøgelser foregår i fuld bedøvelse. Når man tager prøven fra lænderyggen, giver man umiddelbart efter prøvetagningen, kemoterapi ind i spinalvæsken, for at beskytte centralnervesystemet mod leukæmiceller.
Leukæmicellerne i knoglemarven undersøges og karakteriseres ved hjælp af en række forskellige metoder:
- Leukæmicellernes udseende studeres i mikroskop; ofte kan man skelne lymfoblaster fra andre typer leukæmiceller.
- Der undersøges for specielle æggehvidestoffer (proteiner) på leukæmicellernes overflade (immunmarkører), som er karakteristiske for forskellige undertyper af lymfoblaster (umodne B-celler, modne B-celler og T-celler). Sådanne karakteristiske ændringer anvendes senere i behandlingsforløbet til at spore små mængder af resterende leukæmiceller (MRD = Minimal Residual Disease = restsygdom).
- Med gendiagnostiske metoder fastlægges specifikke ændringer i leukæmicellernes DNA-strenge. Sådanne karakteristiske ændringer kan anvendes senere i behandlingsforløbet til at spore små mængder af resterende leukæmiceller (MRD = restsygdom).
- Leukæmicellerne dyrkes i vækstmedium med henblik på kromosomundersøgelse, som ofte viser karakteristiske ændringer af kromosomernes antal eller udseende.
Rygmarvsvæsken undersøges for indhold af leukæmiceller ved celletælling, mikroskopi og immunmarkører.
Herudover foretages forskellige billeddiagnostiske undersøgelser. Der tages altid et røntgenbillede af hjerte og lunger for at se, om der er leukæmiansamling i brisselen (thymus) eller i lymfeknuder i brysthulen (ses blandt andet ved T-celle leukæmi). I nogle tilfælde foretages supplerende billeddiagnostiske undersøgelser.
Behandling af ALL
Leukæmi behandles med cellegifte (kemoterapi). Behandlingen er baseret på en international behandlingsprotokol udviklet af eksperter fra 14 europæiske lande, som alle benytter samme protokol, der hedder ’ALLTogether-protokollen’. De fleste børn med ALL behandles ifølge denne, som i det følgende beskrives i hovedtræk. Børn, som får ALL i første leveår, og børn med moden B-celle-ALL samt Ph+-ALL, behandles efter særlige protokoller, som ikke beskrives her.
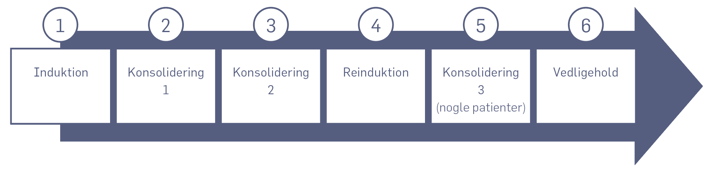
Behandling med kemoterapi gives i fem eller seks faser, der er vist i diagrammet nedenfor.
I hver behandlingsfase gives en kombination af flere kemoterapeutika. Nogle gives via munden som tabletter eller en opløsning (oralt), andre direkte i blodstrømmen som en injektion eller en infusion (intravenøs). Derudover gives noget kemoterapi direkte i rygmarvsvæsken (cerebrospinalvæske). Dette sker ved lumbalpunktur under bedøvelse.
Kemoterapibehandlingen gives for det meste som ambulant behandling, men der vil være perioder, hvor dit barn bliver nødt til at overnatte på hospitalet til behandling med kemoterapi, eller hvis barnet bliver dårligt pga. infektion eller andre bivirkninger til behandlingen.
Behandling med kemoterapi
- Induktionsbehandlingen, de første 4 uger af behandlingen, skal tilvejebringe (inducere) remission (fjerne leukæmicellerne).
- Konsolideringsbehandlingerne skal befæste (konsolidere) den opnåede remission.
- Reinduktionsbehandlingen minder på mange måder om startinduktionsbehandlingen. Skal reducere mængden af restsygdom.
- Vedligeholdelse, den længste og mest skånsomme fase af behandlingen. Det er overvejende tablet-/mikstur-behandling med cellegifte, som skal reducere risikoen for, at leukæmien kommer tilbage på et senere tidspunkt.
Effekten af behandlingen kontrolleres ved knoglemarvsundersøgelse efter 2, 4 og for de flestes vedkommende 10 ugers behandling.
Efter de første 4 ugers behandling placeres man i en ud af fire behandlingsarme. Disse er kendt som Standard Risiko (SR), Lav Intermediær Risiko (IR-lav), Høj Intermediær Risiko (IR-høj), eller Høj Risiko (HR), hvor risiko betyder sandsynligheden for at leukæmien kan komme tilbage. Denne placering sker ud fra resultater på tests taget ved diagnosen, bl.a. typen af ALL, om der findes genetiske fejl i leukæmicellerne og om der er involvering af leukæmi i centralnervesystemet. Resultaterne af disse test bliver sammenholdt med behandlingseffekten, målt som mængden af målbar restsygdom i knoglemarven (MRD). Dette gøres for at fastlægge, hvor intensive de næste behandlingsfaser skal være.
Patienter i SR-gruppen har ikke målbar sygdom ved 4 ugers knoglemarvsundersøgelsen og fortsætter resten af behandlingen som SR. Patienter i IR-lav, IR-høj og HR får yderligere målt restsygdom i knoglemarven dag 78 og placeres herefter i den endelige behandlingsgruppe. Næsten alle børn vil efter fire ugers behandling være bragt i remission, dvs. en tilstand, hvor der ikke er symptomer på sygdommen, og hvor der ikke er mikroskopisk synlige leukæmiceller i knoglemarv eller andre steder i kroppen.
Selv om sygdommen tilsyneladende er væk, resterer der skjulte celler (minimal restsygdom = MRD), som skal udryddes ved fortsat cellegiftbehandling for at undgå tilbagefald (recidiv). Det er nødvendigt at give langvarig behandling, og den samlede behandlingsvarighed er 2 år og 1 mdr.
Behandlingsvarighed
- De børn og unge, som har leukæmi af typen præ-B-ALL, ingen involvering af centralnervesystemet, ingen ugunstige genetiske forandringer i leukæmicellerne, og som reagerer så godt på behandlingen, at den ikke længere kan cellerne, og som reagerer så godt på behandlingen, at den ikke længere kan måles efter 4 ugers behandling, får kemoterapi efter Standard Risiko (SR)-protokollen. Behandlingsvarigheden er 2 år og 1 mdr. Denne gruppe udgør ca. 22 % af alle børn med ALL.
- De børn og unge, som har nogle ugunstige genetiske forandringer i leukæmicellerne og dårlig effekt af startbehandlingen, skal behandles efter Høj Risiko-protokollen (HR). Denne gruppe udgør kun ca. 3 % af alle børn og unge med ALL. Nogle af disse børn og unge vil blive behandlet med kemoterapi i 2 år og 1 mdr. Andre vil blive behandlet med knoglemarvstransplantation efter 4-6 måneders kemoterapi, og endelig vil enkelte blive tilbudt en ny lovende eksperimentiel behandling kaldet CAR-T.
- For de resterende 75 % af børn og unge med ALL kan der fortsat måles en anelse restsygdom efter 4 ugers behandling, eller børnene har leukæmi af typen T-ALL, involvering af centralnervesystemet eller nogle ugunstige genetiske forandringer i leukæmicellerne. De skal behandles efter enten Lav Intermediær Risiko-(IR-lav) eller IR-høj-protokollen. Behandlingens varighed er 2 år og 1 mdr.
De anvendte cellegifte vil fremgå af de skemaer, som hvert enkelt barn bliver behandlet efter.
Bivirkninger til behandling af ALL
Under de første 4 ugers behandling vil ca. hvert syvende barn opleve mere alvorlige bivirkninger. Det kan blandt andet være i form af svære infektioner, betændelse i bugspytkirtlen eller blodpropper.
På grund af forskellige behandlingsmoduler i de 4 behandlingsgrupper, er der også forskelle i hyppigheden og typen af bivirkninger som følge af behandlingen. I behandlingsgrupperne SR og IR vil omkring en tredjedel opleve mere alvorlige bivirkninger undervejs. Oftest i form af svære infektioner, betændelse i bugspytkirtlen samt blodpropper. I gruppen HR vil ligeledes en tredjedel opleve mere alvorlige bivirkninger. I denne gruppe er det ligeledes især svære infektioner og derudover blodpropper, alvorlige blødninger og nyreproblemer der er de hyppigste bivirkninger til behandlingen.
Prognose ved ALL
Cellegifte blev taget i anvendelse til leukæmibehandling omkring 1950. I 1960’erne lykkedes det at helbrede de første børn med ALL. Siden da har intensiv forskning og internationalt samarbejde med randomiserede behandlingsforsøg (“lodtrækningsforsøg”) bevirket en markant forbedring af prognosen. Med de behandlinger, der anvendes i dag, bliver mere end 90 % af børnene helbredt. Helbredelseschancen er afhængig af sygdomsfaktorer, den givne behandling og forskellige individuelle forhold.
De danske børnekræftafdelinger deltager i det nordiske samarbejde om behandling af børn med ALL. Dette samarbejde blev etableret i 1981, og siden er mere end 7000 børn behandlet efter fælles nordiske protokoller. På grundlag af erfaringerne er protokollerne blevet revideret med mellemrum, og på 30 år er det lykkedes at øge den procentdel af børn, som ikke får tilbagefald, fra ca. 50 % til mere end 90 %. De nuværende resultater er på højde med de bedste resultater i udlandet. Med den nye ALLTogether protokol er samarbejdsgruppen blevet udvidet betydeligt til nu at dække 14 europæiske lande. Vores nordiske gruppe har haft en helt central rolle i udformningen af ALLTogether protokollen og arbejdet med protokollen ledes af den nordiske gruppe fra Stockholm. Med ALLTogether protokollen anslås det, at der hvert år vil inkluderes ca 1500 børn, hvilket gør det muligt at kunne undersøge effekten af ændringer i ALL-behandlingen.
I ALLTogether protokollen vil der være tre ændringer til standardbehandlingen i form af lodtrækningsforsøg (randomiseringer). I forsøgene tildeles halvdelen af børnene standardbehandling og den anden halvdel ændringen til behandlingen. Det er helt frivilligt, om man vil deltage i forsøgene, og tildelingen til de to grupper sker ved et tilfældighedsprincip (som at vende en mønt). Forsøgene er designet til at undersøge om ændringer i standardbehandlingen dels kan reducere bivirkningerne af behandlingen, dels kan reducere risikoen for, at sygdommen vender tilbage. I vil blive informeret grundigt omkring dette samt underskrive en samtykkeerklæring, såfremt I ønsker at jeres barn skal deltage i et af disse forsøg, som først er aktuelle i enten reinduktionsfasen eller vedligeholdelsesfasen.
Der findes 5 måder behandlingen kan svigte:
- Død under induktionen (ca. 1%)
- ALL der ikke reagerer på behandlingen (resistens) (1 %)
- Tilbagefald (recidiv) (7 %)
- Død af bivirkninger til behandlingen trods god effekt af behandlingen (død i remission) (2-3 %)
- Senere kræft af anden type (1-2 %)
Tilbagefald (recidiv) kan undertiden vise sig i vedligeholdelsesfasen, men indtræder som regel først efter, at behandlingen er ophørt. De fleste tilbagefald sker i det første år efter behandlingsophør, nogle i det andet. Det er sjældent, at der kommer tilbagefald mere end 5 år efter, at sygdommen blev konstateret.
Børn og unge, der får et sent recidiv, kan som oftest helbredes med almindelig kemoterapi, men ved tidligt recidiv er dette sjældent tilstrækkeligt, og behandlingen af dette er knoglemarvstransplantation og/eller forskellige eksperimentelle tilbud.